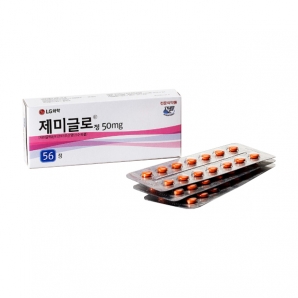
상품상세정보
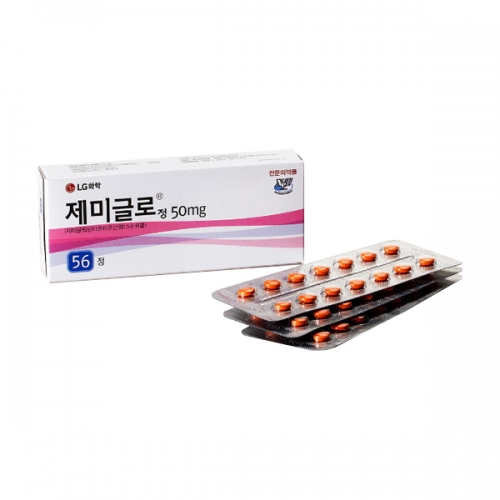
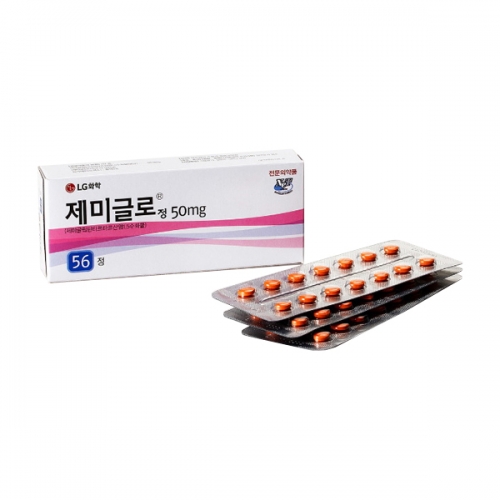
외형정보
· 성상 : 레몬형의 주황색 필름코팅정
· 제형 : 필름코팅정
· 모양 : 레몬형
· 색상 : 주황
· 분할선 : -
· 식별표기 : (앞)마크, (뒤)분할선
성분정보
제미글립틴타르타르산염1.5수화물 68.9mg
저장방법
기밀용기, 실온(1~30℃)보관
효능효과
이 약은 인슐린 비의존성(제2형) 당뇨병환자의 혈당조절을 향상시키기 위해 식사요법 및 운동요법의 보조제로 투여한다.
1. 이 약은 단독요법으로 투여한다.
2. 이 약은 다음의 경우 병용요법으로 투여한다.
- 메트포르민 단독요법으로 충분한 혈당조절을 할 수 없는 경우 이 약을 병용투여한다.
- 이전 당뇨병 약물치료를 받은 경험이 없으며 단독요법으로 충분한 혈당조절이 어려운 경우 메트포르민과 병용투여한다.
- 메트포르민과 설포닐우레아 병용요법으로 충분한 혈당조절을 할 수 없는 경우 이 약을 병용투여한다.
- 인슐린 요법(인슐린 단독 또는 메트포르민 병용)으로 충분한 혈당조절을 할 수 없는 경우 이 약을 병용투여한다.
용법용량
이 약은 단독요법 또는 병용요법 시 1일 1회 50 mg을 투여하며 1일 최대용량은 50 mg이다. 이 약은 식사와 관계없이 투여할 수 있다.
설포닐우레아 또는 인슐린과 병용투여 시에는 저혈당 발생의 위험을 감소시키기 위해 설포닐우레아 또는 인슐린의 감량을 고려할 수 있다.
신장애 환자에서 용법·용량 조절이 필요하지 않다.
경증 및 중등도의 간장애 환자에서 용법·용량 조절이 필요하지 않다.
사용상 주의사항
1. 다음 환자에는 투여하지 말 것
1) 본제 또는 다른 dipeptidyl-peptidase 4(DPP4) 저해제에 아나필락시스 혹은 혈관 부종 등의 중대한 과민반응을 보인 환자
2) 제1형 당뇨병 또는 당뇨병성 케톤산증 환자
2. 다음 환자에는 신중히 투여할 것
1) 설포닐우레아제를 투여중인 환자
2) 심부전 환자 : New York Heart Association(NYHA) functional class I의 심부전이 있는 환자에서 투여 경험이 제한적이므로, 이들 환자에서는 신중히 사용하여야 한다. NYHA functional class II-IV 환자에서의 임상경험이 없기 때문에 이 약의 사용이 권장되지 않는다.
3) 중증 간장애 환자: 중증의 간장애 환자를 대상으로 한 임상시험은 실시되지 않았으므로 이들 환자에게는 신중히 투여한다.
4) 급성 췌장염 : 이 약을 포함한 다른 DPP-4 억제제 계열에서 췌장염이 보고되었다. 따라서 지속적인 중증 복통과 같은 급성 췌장염의 특징적인 증상을 환자에게 알려주어야 한다. 만약 투여 시작 후 췌장염이 의심될 경우 이 약의 투여를 중단해야 하며, 다시 투여해서는 안 된다. 췌장염의 병력이 있는 환자에서는 주의해서 사용하여야 한다.
5) 이 약은 황색5호를 함유하고 있으므로 이 성분에 과민하거나 알레르기 병력이 있는 환자에는 신중히 투여한다.
3. 이상반응
1) 임상시험은 광범위하고 다양한 조건 하에서 실시되므로 임상시험에서 관찰된 이상반응 발생률은 다른 약물의 임상시험에서의 발생률과 직접적으로 비교될 수 없으며, 실제 사용환경 하에서 관찰된 발생률을 반영할 수 없다.
52주간 이 약 50mg을 1일 1회 단독투여한 환자에서 연장기간(후반 28주)동안 인과관계 평가와 관계없이 보고된 이상반응 중 24주 시험 대비 발생빈도가(환자수) 1% 이상 증가한 이상반응은 코인두염(Nasopharyngitis, 4.44% vs 6.1%), 상기도감염(Upper respiratory tract infection, 1.1% vs 6.1%), 혈중 CPK 수치증가(Blood creatine phosphokinase increased, 2.22% vs 4.88%)가 있었고, 24주 시험 대비 새로 보고된 이상반응 중 2명(2.44%) 이상에서 발생된 이상반응은 없었다.
52주간 메트포르민과 이 약 50mg 1일 1회를 추가 병용투여한 환자에서 연장기간(후반 28주) 동안 인과관계 평가와 관계없이 보고된 이상반응 중 24주 시험 대비 발생빈도가(환자수) 1% 이상 증가한 이상반응은 설사(Diarrhoea, 0.71% vs 2.7%), 요로감염(Urinary tract infection, 0.71% vs 1.8%), 저혈당(Hypoglycaemia 0.71% vs 2.7%), 어지러움증(Dizziness, 0.71% vs 3.6%), 구역(Nausea, 1.43% vs 2.7%)이 있었고, 24주 시험 대비 새로 보고된 이상반응 중 2명(1.8%) 이상에서 발생된 이상반응은 무력증(Asthenia, 1.8%), 근육통(Myalgia, 1.8%)이 있었다.
52주간 이 약 50mg 1일 1회를 투여한 중등도 및 중증 신장애 환자에서 연장기간(후반 40주) 동안 인과관계 평가와 관계없이 보고된 이상반응 중 12주 시험 대비 발생빈도가(환자 수) 3% 이상 증가한 이상반응은 저혈당(Hypoglycaemia, 8.0% vs. 16.0%), 고혈당증(Hyperglycaemia, 2.0% vs. 6.0%), 코인두염(Nasopharyngitis 6.0% vs. 14.0%), 관절통(Arthralgia, 4.0% vs. 10.0%), 등통증(Back pain, 2.0% vs. 6.0%)이 있었고, 12주 시험 대비 새로 보고된 이상반응 중 2명(4.0%) 이상에서 발생된 이상반응은 손발톱진균증(Onychomycosis, 4.0%), 위장염(Gastroenteritis, 4.0%) 근육연축(Muscle spam, 4.0%), 가슴불편감(Chest discomfort, 4.0%), 가려움증(Pruritus, 6.0%)이 있었다.
이 약 50mg 1일 1회로 12주~24주간 진행된 단독요법 임상시험 2건에서 저혈당은 2명(1.59%)이 보고되었고, 24주간 진행된 메트포르민과의 추가 병용요법 임상시험에서 1명(0.71%)이 보고되었다. 이 약 50mg을 1일 1회 메트포르민 최대 2000mg과 초기 병용요법 임상시험에서 저혈당은 3명(2.13%)이 보고되었다. 이 약 50mg 1일 1회로 52주간 투여 시 연장기간(후반 28주) 동안 보고된 저혈당은 병용요법 임상시험에서 3명(2.7%)이 있었다. 글리메피리드와 메트포르민에 반응하지 않는 환자에게 이 약 50mg을 1일 1회 추가 병용투여한 임상시험에서 저혈당은 10명(9.35%)이 보고되었다. 중등도 및 중증 신장애 환자에서 12주간 진행된 임상시험에서 저혈당 발생률은 이 약 50mg 투여군에서 9명(13.6%), 위약군에서 6명(9.1%)이 보고되었으며, 위약 투여군을 리나글립틴으로 변경한 총 52주간 활성대조 연장 임상시험 기간 동안 보고된 저혈당은 이 약 50mg 투여군에서 10명(20.0%), 활성대조군에서 15명(28.9%)이었다. 보고된 저혈당은 대부분 경증이었고 모두 회복되었다.다파글리플로진 및 메트포르민과의 병용으로 투여로 적절히 혈당 조절이 되지 않는 환자에게 이 약 50mg 또는 그 위약을 1일 1회 24주간 추가 병용 투여한 임상시험에서 저혈당 발생률은 이 약 50mg 투여군에서만 1명(0.63%) 보고되었으며 저혈당 단계는 1단계(주의가 필요한 저혈당, Hypoglycemic alert value)로 임상시험 기간 중 회복되었으며 이 약과 관련은 없었다.
인슐린 단독 또는 메트포르민과 병용투여로 적절히 혈당 조절이 되지 않는 환자에게 이 약 50mg 또는 그 위약을 1일 1회 24주간 추가 병용투여 한 임상시험에서 저혈당 발생률은 이 약 50mg 투여군에서 29명(15.1%), 위약군에서 15명(15.6%)이 보고되었다. 이 중 증상을 동반한(Symptomatic) 저혈당의 발생률은 이 약 50mg 투여군 11명(5.7%), 위약군 5명(5.2%)으로 경증 또는 중등증이었고 모두 회복되었고 대부분 이 약과 관련은 없었다. 증상을 동반하지 않은(Asymptomatic) 저혈당의 발생률은 이 약 50mg 투여군 21명(10.9%), 위약군 10명(10.4%)이었다.
과민반응
24주간 진행된 활성대조 추가 병용요법 임상시험에서 메트포르민의 안정된 용량에 이 약 25mg 1일 2회 투여군에서 연장기간(후반 28주) 동안 이 약 50mg 1일 1회로 변경하여 복용한 군에서 과민반응이 2명(1.71%) 보고되었고, 이 약과 관련은 없었다.
수포성 유사천포창
다른 DPP-4 저해제를 복용한 환자의 시판 후 조사에서 입원을 필요로 하는 수포성 유사천포창이 보고되었다.
국내에서 재심사를 위하여 6년 동안 3,036명을 대상으로 실시한 시판 후 조사 결과, 이상사례의 발현율은 인과관계와 상관없이 8.17%(248/3,036명, 총 328건)로 보고되었다. 이 중 인과관계와 상관 없는 중대한 이상사례는 발현 빈도에 따라 아래 표에 나열하였다. 인과관계를 배제할 수 없는 중대한 약물이상반응은 보고되지 않았다.
3) 시판 후 국내외 자발보고
다음은 이 약의 시판 후 추가로 확인된 이상사례(Adverse Event)이다. 이러한 이상사례는 불특정 다수의 인구집단에서 자발적으로 보고된 것이기 때문에 발생빈도를 신뢰성 있게 예측하거나 약물노출과의 인과관계를 확립하는 것은 일반적으로 가능하지 않다.
- 구토, 두드러기, 말초부종, 발진, 스티븐스-존슨증후군, 얼굴부종, 입술부기, 췌장염, 폐렴
4. 일반적 주의
1) 저혈당을 일으키는 것으로 알려진 약과의 병용투여: 다른 혈당저하제와의 병용투여가 전형적으로 그렇듯이, 이 약과 설포닐우레아 또는 인슐린을 병용투여 시 저혈당이 관찰되었다. 설포닐우레아 또는 인슐린에 의한 저혈당의 위험을 감소시키기 위해 설포닐우레아 또는 인슐린의 감량을 고려할 수 있다.
2) 중증 및 장애를 동반하는 관절통: 다른 DPP-4 저해제를 복용한 환자의 시판후 조사에서 중증 및 장애를 동반하는 관절통이 보고되었다. 약물 투여 이후 증상의 발생시기는 1일 후부터 수년 후까지 다양하였다. 약물 투여 중지 시에 증상은 완화되었다. 일부 환자에서는 동일한 약 또는 다른 DPP-4 저해제를 다시 복용시에 증상의 재발이 나타났다. 중증관절통의 원인으로 DPP-4 저해제를 고려하여 적절한 경우 투여를 중지한다.
3) 수포성 유사천포창 : 다른 DPP-4 저해제를 복용한 환자의 시판 후 조사에서 입원을 필요로 하는 수포성 유사천포창이 보고되었다. 환자들은 일반적으로 DPP-4 저해제 투여중지 및 국소 또는 전신 면역억제제 치료로 회복되었다. 환자들에게 이 약을 복용하는 동안 수포 또는 짓무름이 발생하면 즉시 의사에게 보고하도록 알려야 한다. 만약, 수포성 유사천포창이 의심되는 경우, 이 약을 중단하고 진단 및 적절한 치료를 위해 피부과 전문의와 상담해야 한다.
4) 과민반응 : 시판 후 이 약을 투여한 환자에서 중증의 과민반응이 보고되었으며, 이 반응은 스티븐스-존슨증후군을 포함한다. 만약 심각한 과민반응이 의심되는 경우, 이 약을 중단하고 반응에 대한 다른 잠재적인 원인을 파악하며 다른 당뇨 치료요법을 실시한다.
5. 상호작용
1) 이 약은 CYP3A4에 의해 주로 대사된다. In vitro 시험에서 CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1및 3A4 대사효소를 저해하지 않았으며, CYP1A2, 2C8, 2C9, 2C19 및 3A4 대사효소를 유도하지 않았다. 따라서 이 약은 위 대사효소들의 기질인 약물과 약물상호작용을 일으킬 가능성이 낮다. 이 약은 in vitro 시험에서 P-당단백(P-gp)을 유도하지 않았고 P-당단백 매개수송을 고농도에서 약하게 저해하였다. 따라서 이 약은 임상용량에서 P-당단백의 기질인 약물과 약물상호작용을 일으킬 가능성이 낮다.
2) 이 약의 다른 약물에 대한 영향
이 약은 약물상호작용 연구에서 메트포르민과 피오글리타존, 글리메피리드, 로수바스타틴, 다파글리프로진 및 엠파글리프로진의 약동학에 임상적으로 유의한 영향을 미치지 않았다. 이 시험에 근거하여 이 약은 CYP2C8, CYP2C9, CYP3A4 및 유기양이온 수송체(OCT)의 기질인 약물과 상호작용을 일으키지 않을 것으로 예상된다.
① 메트포르민: 이 약 50mg과 OCT1과 OCT2의 기질인 메트포르민 2,000mg을 정상상태에 도달하도록 반복투여 하였을 때, 메트포르민의 최고혈중농도는 13% 감소하였으나, 혈중 AUC는 변하지 않았다.
② 피오글리타존: 이 약 200mg과 CYP2C8 및 3A4의 기질인 피오글리타존 30mg을 정상상태에 도달하도록 반복투여 하였을 때, 피오글리타존의 최고혈중농도는 17%, 혈중 AUC는 15% 감소하였으나, 피오글리타존 활성대사체들의 최고혈중농도와 혈중 AUC는 변하지 않았다.
③ 글리메피리드: 이 약 50mg 반복투여 후 정상상태에서 CYP2C9의 기질인 글리메피리드 4mg을 단회 병용 투여 하였을 때 글리메피리드의 약동학적 특성은 변하지 않았다.
④ 로수바스타틴: 이 약 50mg과 CYP2C9 및 3A4의 기질인 로수바스타틴 20mg을 정상상태에 도달하도록 반복투여 하였을 때 로수바스타틴의 약동학적 특성은 변하지 않았다.
⑤ 다파글리프로진: 다양한 UGT isozyme 의 기질인 다파글리프로진 10 mg 을 이 약 50 mg 과 병용투여 하여 정상상태에 도달하였을 때 다파글리프로진의 약동학적 특성은 변하지 않았다.
⑥ 엠파글리프로진: 다양한 UGT 1A9 에 의해 주로 대사되는 엠파글리프로진 25mg 을 이 약 50 mg 과 병용투여 하여 정상상태에 도달하였을 때 엠파글리프로진의 약동학적 특성은 변하지 않았다.
3) 이 약에 대한 다른 약물의 영향
메트포르민, 피오글리타존, 로수바스타틴, 다파글리프로진 및 엠파글리프로진은 약물상호작용 연구에서 이 약의 약동학에 임상적으로 유의한 영향을 미치지 않았다. 케토코나졸은 약물상호작용 연구에서 이 약에 임상적으로 유의한 영향을 미치지 않았으므로, 다른 CYP3A4 저해제들도 이 약과 상호작용을 일으키지 않을 것으로 예상된다. 리팜피신(리팜핀)은 약물상호작용 연구에서 이 약의 체내노출을 유의하게 감소시켰다. 따라서 강력한 CYP3A4 유도제(예: 리팜피신(리팜핀), 덱사메타손, 페니토인, 카르바마제핀, 리파부틴, 페노바르비탈)와의 병용투여는 권장되지 않는다.
① 메트포르민: OCT1과 OCT2의 기질인 메트포르민 2,000mg과 이 약 50mg을 정상상태에 도달하도록 반복투여 하였을 때, 이 약의 약동학적 특성은 변하지 않았다.
② 피오글리타존: CYP2C8 및 3A4의 기질인 피오글리타존 30mg과 이 약 200mg을 정상상태에 도달하도록 반복투여 하였을 때, 이 약의 약동학적 특성은 변하지 않았다.
③ 케토코나졸: CYP3A4의 강력한 억제제인 케토코나졸을 1일 1회 400mg으로 정상상태에 도달하도록 반복투여하고, 이 약 50mg을 단회투여 하였을 때, 모약물과 대사체의 약리적활성을 고려하여 합산한 약리활성체는 케토코나졸과 병용 시 약 1.9배 증가하였다.
④ 리팜피신(리팜핀): CYP3A4의 강력한 유도제인 리팜피신(리팜핀)을 1일 1회 600mg으로 정상상태에 도달하도록 반복투여하고, 이 약 50mg을 단회투여 하였을 때, 이 약의 최고혈중농도는 59%, 혈중 AUC는 80% 감소하였다. 이 약 활성대사체의 최고혈중농도는 거의 변하지 않았고 혈중 AUC는 36% 감소하였다.
⑤ 로수바스타틴: 이 약 50mg과 CYP2C9 및 3A4의 기질인 로수바스타틴 20mg을 정상상태에 도달하도록 반복투여 하였을 때 이 약의 약동학적 특성은 변하지 않았다.
⑥ 다파글리프로진: 다양한 UGT isozyme 의 기질인 다파글리프로진 10 mg 을 이 약 50 mg 과 병용투여 하여 정상상태에 도달하였을 때 이 약의 약동학적 특성은 변하지 않았다.
⑦ 엠파글리프로진: 다양한 UGT 1A9 에 의해 주로 대사되는 엠파글리프로진 25mg 을 이 약 50 mg 과 병용투여 하여 정상상태에 도달하였을 때 이 약의 약동학적 특성은 변하지 않았다.
6. 임부, 수유부에 대한 투여
1) 임부에 대한 투여
① 임부를 대상으로 한 적절한 임상시험 결과는 없으므로 임부에서의 사용은 권장되지 않는다.
② 동물시험 결과, 이 약은 임신한 랫드에 투여 후 2시간에 최대 48.1%, 토끼에서는 투여 후 2시간에 최대 1.6%가 태반을 통과하여 양수에서 검출되었으므로 임부에서의 사용은 권장되지 않는다.
2) 수유부에 대한 투여
이 약은 사람 모유에 분비되는지 알려지지 않았다. 동물시험에서 이 약은 랫드에서 혈장과 유즙에서 1: 4~10비율로 분비되는 것으로 보고되었으므로 이 약을 수유부에는 투여하지 않는다.
7. 소아에 대한 투여
18세 미만의 소아 및 청소년에서의 안전성 및 유효성은 확립되지 않았다(사용경험이 없음).
8. 고령자에 대한 투여
이 약의 임상 제2상과 제3상 시험에 참여한 환자(총 1,605명) 중 65세 이상인 고령자는 306명(19.1%)이였다. 고령자에서의 안전성 유효성은 젊은 환자와 유사하였다. 고령자는 일반적으로 간장, 신장 기능 등 생리기능이 저하되어 있으므로, 환자의 상태를 관찰하여 신중히 투여하여야 한다.
9. 과량투여시의 처치
이 약의 임상시험에서 건강한 성인을 대상으로 이 약 50mg을 일일 600mg까지 10일 반복투여 한 경험이 있다. 이 약 일일 600mg을 단회 투여한 연구에서 심박동 증가가 한 건 관찰되었다. 사람에서 일일 600mg을 초과하여 투여한 경험은 없다.
과량투여 시에는 일반적인 대증치료(예를 들면 흡수되지 않은 약물을 위장관계로부터 제거하고 심전도를 포함한 임상모니터링을 실시)를 하며, 환자의 상태에 따라 보조적인 치료를 실시한다.
10. 보관 및 취급상의 주의사항
1) 어린이의 손이 닿지 않는 곳에 보관한다.
2) 의약품을 원래 용기에서 꺼내어 다른 용기에 보관하는 것은 의약품 오용에 의한 사고 발생이나 의약품 품질 저하의 원인이 될 수 있으므로 원래의 용기에 보관한다.
11. 전문가를 위한 정보
1)임상시험 정보
단독요법
운동 및 식이요법으로 혈당 조절이 잘 되지 않는 제2형 당뇨병 환자를 대상으로 이 약 50mg 또는 위약을 1일 1회 투여한 다국적, 다기관, 무작위 배정, 위약 대조, 평행 비교, 이중 눈가림, 24주 임상시험에서 이 약의 단독요법에 대한 유효성과 안전성이 평가되었다. 24주 후 기저치 대비 HbA1c의 평균 변화량은 이 약 및 위약에서 각각 –0.64%, 0.08%였다. 위약 대비 HbA1c 변화량 차이는 –0.71% (95% CI: -1.04, -0.37)로 통계적으로 유의하게 감소하였다 (p-value <0.0001).
병용요법
메트포르민 단독요법에 대한 이 약의 추가 병용
메트포르민 단독요법(≥1,000 mg/일)으로 혈당 조절이 잘 되지 않는 제2형 당뇨병 환자를 대상으로 이 약 50mg 및 시타글립틴 100 mg을 추가 병용 투여한 다국적, 다기관, 무작위 배정, 활성 대조, 평행 비교, 이중 눈가림 24주 임상시험에서 이 약의 유효성과 안전성을 활성 대조군 대비 비교 평가하였다. 이 약 50 mg를 1일 1회, 이 약 25 mg를 1일 2회, 또는 시타글립틴 100 mg을 1일 1회 병용투여 하였으며, 24주 후 기저치 대비 HbA1c의 평균 변화량은 이 약 50 mg (25mg 1일 2회) -0.87%, 이 약 50 mg -0.82%, 및 시타글립틴 100 mg –0.92%였다. 시타글립틴 대비 HbA1c 변화량 차이는 0.06% (90% CI 상한 : 0.23) (50mg 1일 1회), 0.04% (90% CI 상한 : 0.20) (25mg 1일 2회)로 비열등성을 입증하였다 (비열등성 마진 : 0.4).
메트포르민과 초기 병용
혈당 조절이 잘 되지 않는 제 2형 당뇨병 환자를 대상으로 이 약 50 mg과 메트포르민(500 mg 이상)을 1일 1회 초기 병용투여하거나, 각각의 단독요법으로 1일 1회 투여한 다국적, 다기관, 무작위 배정, 활성 대조, 평행 비교, 이중 눈가림, 24주 임상시험에서 이 약의 유효성과 안전성을 평가하였다. 24주 후 기저치 대비 HbA1c의 평균 변화량은 병용투여군 -2.06%, 이 약 50mg과 메트포르민 단독투여 그룹에서 각각 –1.24%, -1.47%였다. 각각의 단일제 대비 HbA1c 변화량 차이는 –0.82% (95% CI: -1.02, -0.63) (이 약 단독요법), -0.62% (95% CI: -0.82, -0.41) (메트포르민 단독요법)로, 통계적으로 유의하게 감소하였다 (p-value <0.0001).
메트포르민과 설포닐우레아 병용요법에 대한 이 약의 추가 병용
메트포르민(≥1,000 mg/일)과 글리메피리드(≥4 mg /일 또는 최대 허용 용량)의 병용요법으로 혈당 조절이 잘 되지 않는 제2형 당뇨병 환자를 대상으로 이 약 50mg 또는 위약을 1일 1회 추가 병용 투여한 다기관, 무작위 배정, 위약 대조, 평행 비교, 이중 눈가림 24주 임상시험에서 이 약의 유효성과 안전성을 평가하였다. 24주 후 기저치 대비 HbA1c의 평균 변화량은 이 약과 위약 그룹에서 각각 –0.73%, 0.14%였다. 위약 대비 HbA1c 변화량 차이는 –0.87% (95% CI: -1.09, -0.64)로 통계적으로 유의하게 감소하였다 (p-value <0.0001).
인슐린(+/- 메트포르민) 요법에 대한 이 약의 추가병용
인슐린 단독 또는 인슐린과 메트포르민(≥1,000 mg/일) 병용 투여에도 혈당 조절이 잘 되지 않는 제2형 당뇨병 환자들에게 이 약 50 mg 또는 위약을 1일 1회 추가 병용 투여한 다국적, 다기관, 무작위 배정, 위약 대조, 평행 비교, 이중 눈가림 임상시험에서 이 약의 유효성과 안전성을 평가하였다. 24주 후 기저치 대비 HbA1c의 평균 변화량은 이 약과 위약 그룹에서 각각 –0.77%, -0.08%였다. 위약 대비 HbA1c 변화량 차이는 –0.69% (95% CI: -0.94, -0.43) 로 통계적으로 유의하게 감소하였다 (p-value <0.0001).
메트포르민과 다파글리플로진 병용요법에 대한 이 약의 추가 병용
메트포르민(≥1,000 mg/일)과 다파글리플로진 (10 mg/일)의 병용요법으로 혈당 조절이 잘 되지 않는 제2형 당뇨병 환자를 대상으로 이 약 50mg 또는 위약을 1일 1회 추가 병용 투여한 다기관, 무작위 배정, 위약 대조, 평행 비교, 이중 눈가림 24주 임상시험에서 이 약의 유효성과 안전성을 평가하였다. 24주 후 기저치 대비 HbA1c의 평균 변화량은 이 약과 위약 그룹에서 각각 –0.86%, -0.20%였다. 위약 대비 HbA1c 변화량 차이는 –0.66% (95% CI: -0.80, -0.52)로 통계적으로 유의하게 감소하였다 (p-value <0.0001).
특수집단에 대한 임상정보
신장애가 있는 환자
중등도 또는 중증의 신장애를 동반한 제2형 당뇨병 환자를 대상으로 이 약 50 mg 또는 위약을 1일 1회 투여한 다기관, 무작위 배정, 위약 대조, 평행 비교, 이중 눈가림 12주 임상시험에서 이 약에 대한 유효성과 안전성이 평가되었다. 12주 후 기저치 대비 HbA1c의 평균 변화량은 이 약 및 위약에서 각각 –0.96%, 0.21%였다. 위약 대비 HbA1c 변화량 차이는 –1.20% (95% CI: -1.53, -0.87)로 통계적으로 유의하게 감소하였다 (p-value <0.0001).
2) 독성시험 정보
① 암수 랫드에서 50, 150, 450 mg/kg/day 의 용량으로 2년간 수행된 발암성 시험에서, 암수 모두에서 어떠한 종양 발생도 관찰되지 않았다. 이 용량은 AUC를 근거로 비교할 때, 인체 최대권장용량 50 mg/day 의 거의 129 ~ 170 배에 해당되는 노출량이다. 암수 유전자변형마우스를 대상으로 이 약을 수컷에는 200, 400, 800 mg/kg/day, 암컷에는 200, 600, 1200 mg/kg/day 용량으로 6개월간 투여한 발암성시험을 수행한 결과, 인체 최대권장용량의 약 87배에 해당하는 1200 mg/kg/day에서 어떤 장기에서도 종양 발생이 관찰되지 않았다.
② 이 약은 박테리아를 이용한 복귀 돌연변이(Ames) 시험, 체외염색체 이상 시험, 랫드 및 마우스에서 평가한 체내소핵시험에서 이상변이를 일으키지 않았다.
③ 랫드의 수태능은 800 mg/kg까지 영향이 없었다. 랫드에서 200 mg/kg/day, 토끼에서 300 mg/kg/day까지 최기형성이 없고 안전한 것으로 평가되었고 이는 각 인체최대권장용량의 83배, 153배에 해당하는 용량이다.
④ 랫드에서 800 mg/kg/day (인체최대권장용량의 약 264배)을 경구투여 시 고용량일수록 새끼에서 구개열 기형, 신우확장 변이, 흉선 형태 이상 변이가 증가되었다.
배송안내
- 배송비 : 기본 배송료는 의약품/의료소모품 4,900원 입니다.
- 의약품/의료소모품 70,000원 이상 구매 시 무료배송입니다. (기초수액제 및 일부품목 제외)
- 기초수액제는 1Box단위로 배송비가 별도 부과됩니다.
- 본 상품의 평균 배송일은 입금확인 후 2~3일이며 상품의 종류에 따라 배송기간은 달라질 수 있습니다.
- 배송예정일은 주문시점(주문순서)과 제품 재고 여부에 따라 평균 배송일과는 차이가 발생할 수 있는점 양해 부탁드립니다.
- 사업자 등록증 주소지로만 배송이 가능합니다.
교환 및 반품안내
- 상품수령 후 7일이내 교환 및 반품이 가능합니다.
- 교환 및 반품 절차
교환 및 반품신청 → 택배사 상품회수 → 반품 확인 → 교환 및 환불 완료
- 상품 포장을 개봉하였거나 포장이 훼손되어 상품가치가 상실된 경우,
상품에 낙서 또는 필기가 되어있는 경우 교환 및 반품이 불가합니다.
- 특수상품(향정 및 생물학적제제)은 교환 및 반품이 불가능합니다.
- 일부 특가 이벤트 상품은 교환 및 반품이 불가할 수 있습니다. (제품불량 또는 오배송 제외)
- 고객님의 단순 변심에 의한 교환 및 반품은 왕복 배송비가 부과되는점 양해 부탁드립니다.
환불안내
- 환불 시 반품 여부 확인 후 영업일 3일 이내에 결제 금액을 환불해 드립니다.
- 신용카드 결제시에는 기간에 따라 대금이 청구될 수 있으며 이러한 경우 익월 신용카드 대금청구시 카드사에서 환급처리 됩니다.
- 반품 및 환불에 대한 추가 사항은 고객센터 (02-457-5118)로 문의 주시면 안내드리겠습니다.
AS안내
- 의약품 및 의료소모품은 A/S가 불가합니다.
- 제품 이미지(사진)는 참고용으로 실제 제품과는 다를 수 있습니다.
장바구니 담기
상품이 장바구니에 담겼습니다.
바로 확인하시겠습니까?


 공지사항
공지사항 고객문의
고객문의